آمینها دسته مهمی از ترکیبات آلی هستند که ویژگی بازها را از خود نشان میدهد. این دسته از ترکیبات با توجه به گروههای متغیری که دارند به آمین نوع اول، نوع دوم و نوع سوم تقسیمبندی میشوند و ویژگیهای متفاوتی از خود نشان میدهند. به دلیل اهمیت انواع آمین ها آشنایی با آنها و واکنشهایی که انجام میدهند برای دانشجویان رشته شیمی لازم است.
در این مطلب از مجله فرادرس میخواهیم با انواع آمین ها آشنا شویم و نامگذاری آنها را فرا گیریم. به دلیل گستردگی ترکیبات این دسته آشنایی با روش نامگذاری سیستماتیک آنها اهمیت فراوانی دارد و در این رابطه مثالهایی را نیز مرور میکنیم. در ادامه واکنش شیمیایی انواع آمین ها را با جزئیات بررسی میکنیم و ویژگیهای آنها را نیز مورد بررسی قرار میدهیم. در نهایت نیز به تعدادی مثال و تمرین میپردازیم و درک خود از این مفهوم را عمق میبخشیم.
انواع آمین ها
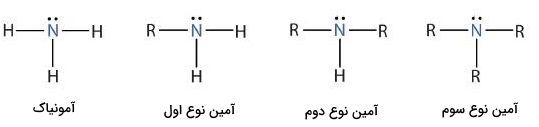
آمینها در شیمی با توجه به تعداد اتمهای کربنی که بهصورت مستقیم به نیتروژن آنها متصل است، به دستههای گوناگونی طبقهبندی میشوند که در زیر فهرستی از آنها را مشاهده میکنید.
- «آمین نوع اول» (Primary Amine): به نیتروژن آمین نوع اول تنها یک اتم کربن بهصورت مستقیم وصل است.
- «آمین نوع دوم» (Secondary Amine): در این نوع آمین، ۲ اتم کربن بهصورت مستقیم به نیتروژن متصل است.
- « آمین نوع سوم» (Tertiary Amine): به نیتروژن این آمین ۳ اتم کربن بهصورت مستقیم وصل است.
در تصویر زیر میتوانید انواع آمینهای موجود را مشاهده کنید. ساختار آمونیاک فاقد اتم کربن متصل به نیتروژن است و به هیچ کدام از این دستهها تعلق ندارد.
آمینها با توجه به گروههای متغیر $$R$$ میتوانند انواع بسیار متفاوتی داشته باشند و ترکیبات زیادی را تشکیل دهند. به همین جهت نیاز به روشی سیستماتیک برای نامگذاری آنها داریم تا بتوان مولکولهای آمین را از یکدیگر تشخیص داد. در بخش میخواهیم به روش نامگذاری آمینها بپردازیم و مثالهایی را بررسی کنیم.
مثال از انواع آمین ها
در تصویر زیر ۴ مولکول از انواع آمین ها را مشاهده میکنید. با توجه به دستهبندی انواع آمین ها، بگویید هر کدام چه نوع آمینی هستند؟

پاسخ
میدانیم که نوع آمین را با توجه به گروههای آلکیلی مشخص میکنند که بهصورت مستقیم به نیتروژن متصل باشد. در مولکول شماره ۱ تنها ۱ زنجیره کربنی به نیتروژن وصل است که از چهار اتم کربن تشکیل میشود. در این صورت مولکول شماره ۱، آمین نوع اول است.
مولکول شماره ۲ نیز آمین نوع اول است زیرا تنها ۱ گروه آلکیلی به آن وصل است. توجه داشته باشید که داشتن ۳ اتم کربن روی آن کربن متصل، تفاوتی در نوع آمین ایجاد نمیکند.
در مولکول شماره ۳، در دو طرف اتم نیتروژن دو گروه آلکیلی وجود دارد، بنابراین آن را آمین نوع دوم مینامیم. در نهایت به مولکول شماره ۴ میرسیم که آمین نوع سوم است زیرا به نیتروژن آن سه گروه آلکیلی بهصورت مستقیم وصل شده است.
نامگذاری انواع آمین ها
روشی متداول برای نام گذاری انواع آمین ها وجود دارد که در آن گروههای آلکیلی متصل به اتم نیتروژن را به ترتیب و بر اساس حروف الفبا پیش از نام آمین میآورند. برای مثال به نامهای مولکولهای آمین بالا در این روش توجه کنید.
- مولکول شماره ۱: نرمال-بوتیل آمین
- مولکول شماره ۲: ترت-بوتیل آمین
- مولکول شماره ۳: متیل پروپیل آمین
- مولکول شماره ۴: اتیل دیمتیل آمین
با این حال مانند دیگر ترکیبات آلی برای انواع آمین ها نیز روشی سیستماتیک وجود دارد که در ادامه به بررسی قوانین مسلط بر آن میپردازیم.
نامگذاری انواع آمین ها به روش آیوپاک
در نامگذاری انواع آمین ها به روش آیوپاک، گروه عاملی آمین را بهصورت استخلافی بر بلندترین و بزرگترین گروه آلکیلی متصل در نظر میگیرند. برای درک بهتر میخواهیم آمینهای بررسی شده در مثال قبلی را به این روش نامگذاری کنیم.
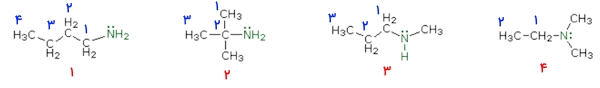
مولکول ۱
پیشتر گفتیم که این آمین از نوع اول است. ابتدا زنجیره متصل به آن را عددگذاری میکنیم، همانطور که مشاهده میکنید این زنجیره استخلافی ندارد، بنابراین شمارهگذاری را بهصورتی انجام میدهیم که به کربن متصل به اتم نیتروژن کمترین عدد نسبت داده شود. این زنجیره دارای ۴ اتم کربن است و بوتان نامیده میشود، بنابراین نام این آمین «۱-آمینو بوتان» است که ۱ نشاندهنده موقعیت اتم کربن متصل به نیتروژن است.
مولکول ۲
این مولکول نیز آمین نوع اول است اما هیدروکربن متصل به آن راستزنجیر نیست. این زنجیره را شمارهگذاری میکنیم و به کربن متصل به نیتروژن عدد ۲ نسبت داده میشود. توجه داشته باشید که میتوان شمارهگذاری را از دو اتم کربن انتهایی دیگر نیز شروع کرد که در هر دو مورد نتیجه یکسان است و کربن متصل به نیتروژن در موقعیت ۲ خواهد بود.
روی زنجیره کربنی یک استخلاف متیل وجود دارد که باید همراه با موقعیت خود آورده شود، بنابراین نام این مولکول «۲-آمینو ۲-متیل پروپان» است. در این نامگذاری عدد ۲ پیش از آمینو نشاندهنده این است که گروه آمین به کربن در موقعیت ۲ وصل شده است. همچنین متیل روی کربن شماره ۲ پروپان وجود دارد.
مولکول ۳
در این مثال با آمین نوع دوم روبرو هستیم. همانطور که پیشتر گفتیم در نامگذاری آیوپاک انواع آمین ها، آن را بهصورت استخلافی بر گروه آلکیلی بزرگتر در نظر میگیریم که در آمین نوع دوم و سوم وجود دارد. در این مثال گروه کوچکتر دارای ۱ اتم کربن و گروه بزرگتر دارای ۳ اتم کربن است، بنابراین گروه کوچکتر را پیش از نام آمین و گروه بزرگتر را پس از آن میآوریم. نام این مولکول بهصورت «۱-متیل آمینو پروپان» صحیح است که در آن عدد ۱ نشاندهنده موقعیت اتصال اتم نیتروژن به پروپان با ۳ اتم کربن است.
مولکول ۴
این مولکول نمونهای از آمین نوع سوم است که دارای دو متیل و یک اتیل است، بنابراین آن را بهصورت استخلافی از اتیل مینامیم. از آنجا که دو متیل وجود دارد، برای پرهیز از تکرار نام آن، از پیشوند شمارشگر «دی» استفاده میکنیم. در این صورت نام این آمین «دیمتیل آمینو اتان» است.
نامگذاری انواع آمین ها به روش $$CAS$$
این روش توسط «خدمات چکیدههای شیمی» (Chemical Abstracts Service) که زیرمجموعهای از انجمن شیمی آمریکا است، معرفی شده است که در ادامه به معرفی آن خواهیم پرداخت. در این روش واژه آمین به آلکیل اصلی وصل میشود. در آمینهای نوع دوم و سوم پیش از آوردن نام گروه از $$N$$ استفاده میکنیم. نحوه نامگذاری به روش $$CAS$$ را در مولکولهای بالا مرور میکنیم تا بهتر با این روش آشنا شویم.

مولکول ۱
در این مولکول که آمین نوع اول است، تنها یک زنجیره متشکل از ۴ اتم کربن به نیتروژن متصل است، بنابراین نام آن بهصورت «بوتان آمین» صحیح است.
مولکول ۲
در مولکول شماره ۲ یک زنجیره پروپان به نیتروژن وصل است که روی خود یک استخلاف متیلی دارد. نام این مولکول بهصورت «۲-متیل ۲-پروپان آمین» صحیح است. در این نامگذاری منظور از ۲ پیش از متیل، موقعیت آن روی زنجیره پروپان است و منظور از ۲ پیش از پروپان، شماره اتم کربنی است که بهصورت مستقیم به نیتروژن وصل شده است.
مولکول ۳
در این آمین که نوع دوم است، یک استخلاف متیل و زنجیرهای با ۳ اتم کربن داریم. نام این مولکول «N-متیل پروپان آمین» است. همانطور که پیشتر توضیح دادیم، در صورت وجود گروهی علاوه بر گروه اصلی که بلندترین زنجیره است، باید از واژه $$N$$ پیش از آن استفاده کنیم، یعنی در این نامگذاری $$N$$ به متیل مربوط است. در واقع گروه کوچکتر را بهصورت استخلاف آلکیلی میآوریم و سپس گروه بزرگتر به همراه واژه آمین میآید.
مولکول ۴
این آمین نوع سوم است و دو گروه متیلی بهصورت استخلافی بر گروه بزرگتر اتیل به همراه آمین به حساب میآید. از آنجا که دو استخلاف وجود دارد باید به ازای هر کدام از آنها یکبار از واژه $$N$$ استفاده کنیم و برای پرهیز از تکرار نام متیل نیز از «دی» بهره میبریم. نام این مولکول بهصورت «NوN-دیمتیل اتان آمین» صحیح است.
انواع آمینهای ویژه
برخی از ساختارهای آمینی آروماتیک و هترواتمی نام ویژهای را به خود اختصاص میدهند. از آنجا که در این نامگذاری از روشی سیستماتیک استفاده نشده است، باید نام آنها را به خاطر بسپاریم. در تصویر زیر به تعدادی از این ساختارها اشاره کردهایم.
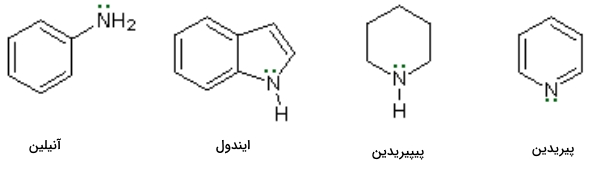
توجه داشته باشید که در ساختار آنیلین، آمین نوع اول است زیرا در آن نیتروژن تنها بهصورت مستقیم به ۱ کربن وصل است. به همین دلیل برای نامگذاری آریل آمینها آنها را بهصورت مشتقاتی از آنیلین نامگذاری میکنیم. برای مثال به دو مولکول زیر توجه کنید.
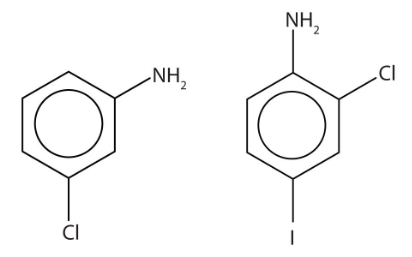
میدانیم که به بنزنی که بهصورت مستقیم به گروه $$NH_2$$ متصل باشد، آنیلین گفته میشود. وجود استخلافهای دیگر در این ساختار را باید با توجه به موقعیت $$NH_2$$ بسنجیم. برای مثال در مولکول سمت چپ یک استخلاف کلر به فاصله یک کربن از آمین قرار داد که جایگاه «متا» (Meta) است. بنابراین میتوان به سادگی این مولکول را «متا کلرو آنیلین» یا «۳-کلرو آنیلین» نامید.
در مولکول سمت راست علاوه بر کلر در موقعیت ۲ نسبت به آمین، یک ید نیز در موقعیت ۴ قرار دارد. برای آوردن نام این دو استخلاف باید به اولویت آنها در حروف الفبا توجه کنیم که در این صورت کلر نسبت به ید ارجح است و نام این آمین بهصورت «۲کلرو ۴-یدو آنیلین» صحیح است.
نامگذاری یون آمونیوم
در یونهای آمونیوم با فرمول شیمیایی $$NH_4^+$$ یک یا تعداد بیشتری از اتمهای هیدروژن با گروههای آلکیلی جایگزین شدهاند. برای نامگذاری این دسته از ترکیبات مشابه نامگذاری آمینهای ساده عمل میکنیم بهصورتی که نام گروههای آلکیلی را به شکل استخلافی از یون آمونیوم میآوریم. برای مثال به مولکول زیر توجه کنید.
$$CH_3NH_3^+$$
در این یون، یکی از هیدروژنهای یون آمونیوم با گروه متیل جایگزین شده است، بنابراین نام آن بهصورت «متیل آمونیوم یون» صحیح است. از همین روش میتوان برای نامگذاری یونهای آنیلین نیز استفاده کرد. این دسته از ترکیبات بهصورت $$C_6H_5NH_3^+$$ هستند و یون آنیلیوم نام دارند.
مثال از نامگذاری آمین
حال که با روشهای نامگذاری انواع آمین ها آشنا شدیم، میخواهیم در این بخش به مرور تعدادی مثال بپردازیم و آنها را نامگذاری کنیم.
مولکول ۱
$$CH_3CH_2CH_2NH_2$$
این آمین نوع اول است زیرا تنها یک کربن روی اتم نیتروژن آن قرار دارد. گروه آلکیلی از ۳ اتم کربن تشکیل شده است و پروپیل نامیده میشود، بنابراین تنها نیاز است نام آن را پیش از آمین بیاوریم. در این صورت نام این آمین «پروپیل آمین» است.
مولکول ۲
$$CH_3CH_2NHCH_2CH_3$$
از آنجا که دو زنجیره هیدروکربنی بهصورت مستقیم به نیتروژن این آمین وصل است، آن را نوع دوم میدانیم. این دو گروه آلکیلی هر دو دارای ۲ اتم کربن هستند و اتیل نام دارند. از طرفی برای پرهیز از تکرار از پیشوند شمارشگر «دی» کمک میگیریم. نام این مولکول به روش متداول «دیاتیل آمین» است.
مولکول ۳
$$CH_3CH_2CH_2NHCH_2CH_2CH_3$$
همانطور که مشاهده میکنید به نیتروژن این آمین دو گروه آلکیلی وصل است که هر کدام دارای ۲ اتم کربن هستند و پروپیل نامیده میشوند. برای تکرار نام پروپیل از پیشوند دی استفاده میکنیم، بنابراین نام این مولکول «دیپروپیل آمین» است.
مولکول ۴
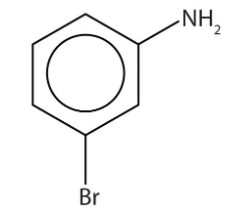
این مولکول آنیلینی است که روی موقعیت ۳ خود یک استخلاف برم دارد. همانطور که میدانید موقعیت ۳ را میتوان متا نیز نامید. بنابراین نام این مولکول بهصورت «متا برمو آنیلین» یا «متا-برمو آنیلین» صحیح است.
واکنش انواع آمین ها
آمینها به دلیل ویژگی بازی که دارند با ترکیبات بسیاری وارد واکنش میشوند. در این بخش میخواهیم به واکنشهای انواع آمین ها بپردازیم و جزئیات هر کدام را بررسی کنیم. پیش از آن توضیحی در مورد ویژگی بازی انواع آمین ها ارائه میدهیم.
بازها را به دو صورت میتوان تعریف کرد. در تعریف برونستد-لوری، باز با یونهای هیدروژن ترکیب میشود. همچنین طبق تعریف اسید و باز لوییس، باز گونهای است که الکترون میدهد. برای درک بهتر بازی بودن آمینها میتوانیم به آنها به چشم مولکول آمونیاکی نگاه کنیم که تغییراتی روی آن انجام شده است. در این صورت آمینها، آمونیاکی هستند که در آنها یک یا چند اتم هیدروژن با گروههای آلکیلی جایگزین شده است.
بعد از این جایگزینی، زوجالکترون روی اتم نیتروژن همچنان سر جای خود باقی میماند، زیرا ویژگیهای بازی این مولکول به همین زوجالکترون بستگی دارد. بنابراین میتوان اینطور جمعبندی کرد که آمینها نیز مانند آمونیاک نقش اسیدی خود را بهخوبی ایفا میکنند. در بخشهای بعدی میخواهیم با توجه به ویژگیهای آمینها، نحوه شرکت آنها در واکنشهای شیمیایی را بررسی کنیم.
واکنش انواع آمین ها با اسیدها
در واکنش انواع آمین ها با اسیدها، میتوان نظریه اسید و باز برونستد-لوری را به خوبی مشاهده کرد که مشابه واکنش آمونیاک با اسیدهاست. زمانی که مولکول آمونیاک با اسیدها وارد واکنش میشود، یون آمونیوم را به وجود میآورد بهصورتی که یکی از یونهای هیدروژن اسیدی را از آن جدا میکند. این هیدروژن سپس به زوجالکترون نیتروژن متصل میشود که میتوانید آن را در تصویر زیر مشاهده کنید.
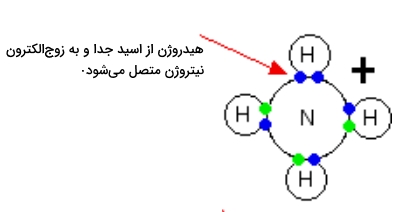
در صورتی که در محیط این واکنش آب نیز حضور داشته باشد، یعنی اسید را پیش از انجام واکنش رقیق کرده باشیم، آمونیاک یک یون هیدروژن (پروتون) را از یون هیدروکسنیوم جدا میکند. این واکنش را میتوانید در زیر مشاهده کنید.
$$ { NH_3 (aq) + H_3O^{+} (aq) rightarrow NH_4^{+} + H_2O (l)} nonumber $$
در صورتی که اسید مورد استفاده در این واکنش هیدروکلریک اسید باشد، بعد از واکنش در محلول، آمونیوم کلرید وجود دارد که یونهای کلرید آن از اسید به دست میآیند. معادله این واکنش را میتوان بهصورت زیر نشان داد.
$$ {NH_3 (aq) + H^{+}rightarrow NH_4^{+} (aq)} nonumber $$
در صورتی که این واکنش در حالت گازی انجام شود، آمونیاک بهصورت مستقیم یک پروتون از هیدروژن کلرید میپذیرد و میتوان واکنش آن را بهصورت زیر نشان داد.
$$ {NH_3 (aq) + HCl (g) rightarrow NH_4^+ (s) + Cl^- (s)} nonumber $$
زوجالکترون نیتروژن در آمین نیز دقیقا همین رفتار را خواهد داشت و جایگزین شدن اتمهای هیدروژن آمونیاک با گروه آلکیلی تفاوتی در آن ایجاد نمیکند. برای مثال به واکنش زیر توجه کنید. در صورتی که واکنش در محلول انجام شود، آمین یک یون هیدروژن دریافت میکند و یون اتیل آمونیوم را به وجود میآورد.
$$ {CH_3CH_2NH_2( aq ) + H_3O^{+}(aq) rightleftharpoons CH_3CH_2NH_3^{+}(aq) + H_2O( l )} nonumber $$
در این واکنش بسته به اسید مورد استفاده، شاهد حضور اتیل آمونیوم کلرید یا اتیل آمونیوم سولفات خواهیم بود. این واکنش را در فاز گازی نیز میتوان انجام داد که آن را در زیر آوردهایم.
$$ { CH_3CH_2NH_2(g) + HCl(g) rightarrow CH_3CH_2NH_3^{+} (s) + Cl^{-} (s)} nonumber $$
توجه داشته باشید که در این واکنشها آمینها از نوع اول هستند اما آمینهای نوع دوم و سوم نیز این واکنش را دقیقا به همین صورت انجام میدهند. برای مثال محصولاتی که به دست میآید برای آمین نوع دوم یون «دیاتیل آمونیوم» و برای آمین نوع سوم یون «تریاتیل آمونیوم» است.
واکنش انواع آمین ها با آب
در این نوع واکنش نیز میتوان مولکول آمونیاک را مورد بررسی قرار داد زیرا دقیقا رفتاری مشابه با رفتار انواع آمین ها در مقابله با آب دارد. آمونیاک بازی ضعیف است و از مولکول آب یک یون هیدروژن میگیرد و یون آمونیوم و هیدروکسید را به وجود میآورد.

با این حال باید به این نکته توجه داشت که آمونیاک بازی ضعیف است و نمیتواند این یون را در کنار خود نگه دارد، از همین رو این واکنش برگشتپذیر است. در بیشتر زمان انجام این واکنش مقدار زیادی از آمونیاک بهصورت آزاد وجود دارد و یونهای آمونیوم کمتر به چشم میخورند. واکنش آمونیاک با آب را میتوانید در زیر مشاهده کنید.
$$ { NH_3(aq) + H_2O(l) rightleftharpoons NH_4^{+} (aq) + OH^{-} (aq)} nonumber $$
وجود یون هیدروکسید بهصورت آزاد در این واکنش باعث قلیایی شدن محیط میشود. واکنش اتیل آمین با آب را در زیر آوردهایم. همانطور که مشاهده میکنید در این واکنش دو محصول یونی اتیل آمونیوم و هیدروکسید به دست میآید.
$$ { CH_3CH_2NH_2 (aq) + H_2O (l)rightleftharpoons CH_3CH_2NH_3^{+} (aq) + OH^{-} (aq)} nonumber$$
نقطه تعادل در این واکنش شیمیایی با واکنش آمونیاک و آب متفاوت است زیرا آمین از آمونیاک باز قویتری به شمار میرود. در صورتی که در آمینی گروه آمین بهصورت مستقیم به حلقه بنزن متصل باشد، این نکته صدق نمیکند.
واکنش انواع آمین ها با یونهای مس
درست مانند آمونیاک، آمینها نیز با مس (II) در دو مرحله وارد واکنش میشوند. برای توجیه مرحله اول میتوان از نظریه برونستد لوری استفاده کرد اما توجیه مرحله دوم تنها با نظریه اسید و باز لوییس ممکن است. برای درک بهتر این واکنش مثالی را مورد بررسی قرار میدهیم.
در محلول مس(II) سولفات، یون آبی رنگی با فرمول شیمیایی $$[Cu(H_2O)_6]^{2+}$$ وجود دارد. در اولین مرحله آمونیاک نقش باز برونستد لوری را ایفا میکند. تنها با مقداری کمی از محلول آمونیاک، یونهای هیدروژن از مولکولهای آب یون ۶ آبه، جدا میشوند که در نتیجه کمپلکسی بدون بار به وجود میآید.
در صورتی که از یک یون با ۲+، دو یون هیدروژن را جدا کنیم، طبیعتا خنثی خواهد شد. به دلیل فقدان بار الکتریکی، این کمپلکس در آب انحلالپذیری ندارد. در نتیجه رسوبی به دست خواهد آمد که به رنگ آبی روشن است. نحوه انجام این واکنش را میتوانید در زیر مشاهده کنید.
$$ {[Cu(H_2O)_6]^{2+} + 2NH_3 rightleftharpoons [Cu(H_2O)_4(OH)_2] + 2NH_4^{+}} nonumber $$
رسوب به وجود آمده در این واکنش را معمولا بهصورت $$Cu(OH)_2$$ نشان میدهد که مس(II) هیدروکسید نامیده میشود. قابل پیشبینی است که این واکنش برگشتپذیر باشد زیرا آمونیاک باز ضعیفی به شمار میرود. در صورت افزودن مقدار مازاد از آمونیاک به محیط این واکنش، این رسوب دوباره حل خواهد شد و رنگ آبی تیره بر جای میگذارد.
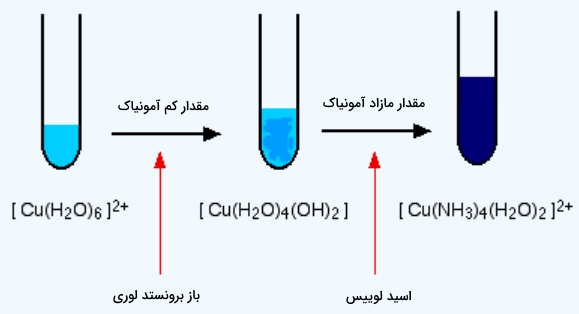
آمونیاک جایگزین ۴ مولکول آب در اطراف مس میشود و یون $$[Cu(NH_3)_4(H_2O)_2]^{2+}$$ را به وجود میآورد. آمونیاک از زوجالکترون خود برای ایجاد پیوند داتیو با مس بهره میبرد که در آن آمونیاک نقش اسید لوییس را بازی میکند. محصول هر واکنش و رنگ آن را میتوانید در تصویر بالا مشاهده کنید.
واکنش آمینهای کوچک نوع اول با مس(II) مشابه واکنش بالا انجام میشوند با این حال تفاوت بسیار جزئی دارد که در ادامه به بررسی آن خواهیم پرداخت.
با مقدار کمی از محلول متیل آمین رسوب آبی کمرنگی از کمپلکس خنثی به دست میآید. اتفاقی که در این مرحله رخ میدهد، خارج شدن یون هیدروژن از آب است که در زیر آن را نشان دادهایم.
$$ {[Cu(H_2O)_6]^{2+} + 2CH_3NH_2 rightleftharpoons [Cu(H_2O)_4(OH)_2] + 2CH_3NH_3^{+}}nonumber $$
با افزودن مقدار اندکی از محلول متیل آمین، رسوب حل میشود و محلول آبی پررنگی ایجاد میشود، درست مانند آنچه در مورد آمونیاک شاهد بودیم. آمین جایگزین ۴ مولکول آب میشود و واکنش زیر صورت میگیرد.
$$ {[Cu(H_2O)_6]^{2+} + 4CH_3NH_2 rightleftharpoons [Cu(CH_3NH_2)4(H_2O)_2]^{2+} + 4 H_2O} nonumber $$
نکتهای که در اینجا باید به آن توجه داشته باشیم این است که با افزایش اندازه آمین، فرمول کمپلکس نهایی تغییر خواهید کرد زیرا ۴ مولکول آمین و ۲ مولکول آب ممکن است نتوانند در اطراف اتم مس خود را جای دهند.
هستهدوستی در انواع آمین ها
«نوکلئوفیل» یا «هستهدوست» (Nucleophile) گونهای است که به بخشهایی از مولکول یا یون دیگر که دارای بار مثبت هستند، تمایل دارد و به آنها حمله میکند.
تمامی انواع آمین ها روی اتم نیتروژن الکترونگاتیو خود یک زوجالکترون دارند که وجود آن باعث هستهدوست بودن انواع آمین ها میشود. در ادامه میخواهیم به تعدادی از واکنشهای آمینها بپردازیم که به دلیل هستهدوست بودن آنها صورت میگیرد.
تولید آمین نوع دوم و نمک آن
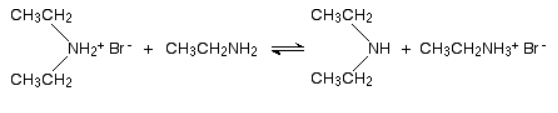
در اولین مرحله این واکنش، نمک آمین نوع دوم به دست میآید که آن را در تصویر زیر مشاهده میکنید. در این واکنش اتیل آمین و برمواتان با یکدیگر ترکیب میشود و دیاتیل آمونیوم برمید را به دست میدهند.
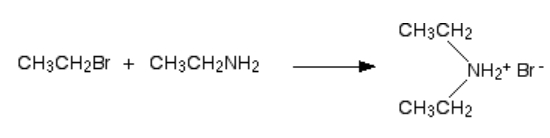
سپس در حضور مقدار مازاد اتیل آمین در ترکیب، احتمال برگشت این واکنش وجود دارد. بهصورتی که اتیل آمین یک هیدروژن را از دیاتیل آمونیوم حذف میکند و دیاتیل آمین را به دست میدهد که یک آمین نوع دوم به شمار میرود. نحوه انجام این واکنش را میتوانید در تصویر زیر مشاهده کنید.
تولید آمین نوع سوم و نمک آن
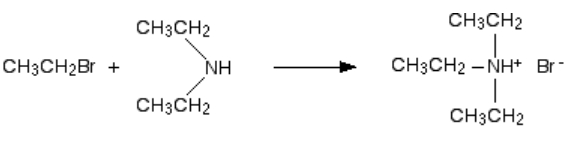
در بخش قبلی، واکنش را تا تولید آمین نوع دوم پیش بردیم اما این واکنش در این نقطه متوقف نخواهد شد. دیاتیل آمین تولید شده نیز با برمواتان وارد واکنش میشود. این واکنش را میتوان از ابتدا با حضور آمین نوع دوم نیز انجام داد. در اولین مرحله آن محصولی بهصورت تریاتیل آمونیوم برمید به دست میآید.
مانند واکنش قبلی در این مورد نیز واکنش میتواند برگشتپذیر باشد. شرط انجام این واکنش حضور اتیل آمین بهصورت مازاد است.
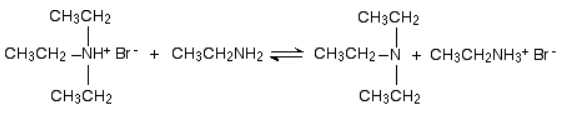
در این واکنش اتیل آمین یون هیدروژن را از یون تریاتیل آمونیوم حذف میکند و یک آمین نوع سوم به نام تریاتیل آمین از آن به جای میماند که محصول واکنش بالا است.
تولید نمک آمونیوم نوع چهارم
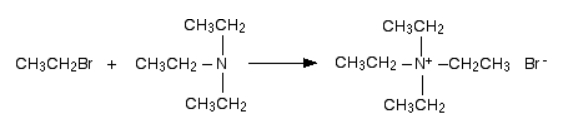
در این بخش شاهد آخرین مرحله این واکنش هستیم که در آن تریاتیل آمین با برمواتان وارد واکنش میشود و تترا اتیل آمونیوم برمید را به دست میدهد. در این یون تمامی هیدروژنهای متصل به نیتروژن با گروههای آلکیلی جایگزین شدهاند. از آنجا که در مولکول هیچ هیدروژنی وجود ندارد، امکان ادامه واکنش با حذف هیدروژن نیز ممکن نیست و واکنش در همینجا پایان مییابد که میتوانید نحوه انجام آن را در تصویر زیر مشاهده کنید.
واکنش انواع آمین ها با آسیل کلریدها
در این مورد از واکنش بین متیل آمین و اتانوئیل کلرید برای توصیف نحوه واکنش استفاده میکنیم. در صورتی که به اتانوئیل کلرید از محلول غلیظ متیل آمین افزوده شود، شاهد انجام واکنشی شدید خواهیم بود. در این واکنش دو محصول ان-متیل اتان آمید و متیل آمونیوم کلرید به دست میآیند و مخلوطی از رسوبی سفید رنگ و محلول هستند. این واکنش را در زیر مشاهده میکنید.
$$ CH_3COCl + 2CH_3NH_2 rightarrow CH_3CONHCH_3 + CH_3NH_3Cl $$
واکنش انواع آمین ها با اسید انیدریدها
واکنش بین آمین و اسید انیدرید از نظر شیمیایی مشابه واکنش بین آمین و آسیل کلرید است که در بخش قبلی به آن پرداختیم اما در این واکنش نیاز به منبع گرما وجود دارد و واکنش با سرعت بسیار کمتری پیشروگری میکند. برای مثال به واکنش زیر که مربوط به متیل آمین و اتانوئیک انیدرید است توجه کنید. یکی از محصولات این واکنش مانند واکنش قبل ان-متیل اتان آمید است اما محصول دیگر در این واکنش متیل آمونیوم اتانوات است.
$$ (CH_3CO)_2O + 2CH_3NH_2 rightarrow CH_3CONHCH_3 + CH_3COO^- + N_3CH_3 $$
واکنش حذف هافمن
آمینها به ندرت نقش گروه ترکشونده را در «واکنش جانشینی هستهدوستی» (Nucleophilic Substitution Reaction) و «واکنش حذفی» (Elimination Reaction) با کاتالیزور بازی ایفا میکنند. آمینهای نوع اول و دوم نسبت به الکلها، اسید ضعیفتری هستند، بنابراین طبیعی است که نیتروژن آنها توانایی ترکشوندگی نداشته باشد. با این حال با آلکیلاسیون آمینها میتوان آنها را به نمک آمونیوم نوع چهار تبدیل کرد که ترکشوندههای خوبی هستند. در واکنش حذفی این نمک به آمین نوع نوع سوم تبدیل میشود.
به واکنش حذف نمکهای آمونیوم نوع چهارم «حذف هافمن» (Hofmann Elimination) گفته میشود. از آنجا که یون مخالف بسیاری از این نمکها، هالیدها هستند، در واکنش با نقره هیدروکسید، توسط هیدروکسید به عنوان باز قویتر، جایگزین خواهند شد. سپس نمک هیدروکسید حاصل را باید تا دمای ۱۰۰ تا ۲۰۰ درجه سانتیگراد رساند تا وارد واکنش حذفی آمین نوع سوم شوند.
برای انجام واکنش حذفی، استخلافی آلکیلی نیتروژن باید دارای هیدروژن بتا باشد. این واکنش مشابه واکنش حذف آلکیل هالیدها است. آمینهای ساده را میتوان به راحتی توسط آلکیلاسیون تبدیل به نمک آمونیوم نوع چهارم کرد و بهطور معمول در این واکنش از متیل یدید استفاده میشود. در زیر میتوانید واکنش کلی آن را مشاهده کنید.

مکانیسم واکنش حذفی هافمن
طی واکنش حذفی هافمن، یون مخالف هیدروکسید نقش باز را ایفا میکند تا هیدروژن بتا را حذف کند. در ادامه واکنش حذفی $$E2$$ انجام میشود و یک آلکن به دست میآید. در این واکنش یک تریآلکیل آمین به عنوان گروه ترککننده حذف خواهد شد. به نحوه انجام این واکنش حذفی در تصویر زیر توجه کنید.
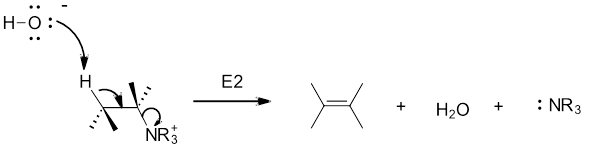
توجه داشته باشید که محصول واکنش حذفی $$E2$$ آلکنی با استخلاف بیشتر است. «قانون هافمن» (Hofmann Rule) به تمایل این نوع واکنش برای تولید محصول ایزومری پیوند دوگانه با استخلاف کمتر گفته میشود.
ویژگیهای انواع آمین ها
حال که با انواع آمین ها و واکنشهای آنها آشنا شدیم، میخواهیم در این بخش به بررسی برخی از ویژگیهای شیمیایی و فیزیکی این دسته از ترکیبات بپردازیم.
نقطه جوش انواع آمین ها
مقایسه نقطه جوش انواع آمین ها اطلاعات زیادی در مورد آنها در اختیار ما قرار میهد. برای مثال در جدول زیر به تعدادی از نقطه جوش آمینهای ساده اشاره کردهایم.
| نوع آمین | فرمول شیمیایی | نقطه جوش بر حسب درجه سانتیگراد |
| آمین نوع اول | $$ CH_3NH_2 $$ | ۶٫۳- |
| آمین نوع اول | $$ CH_3CH_2NH_2 $$ | ۱۶٫۶ |
| آمین نوع اول | $$ CH_3CH_2CH_2NH_2 $$ | ۴۸٫۶ |
| آمین نوع دوم | $$ (CH_3)_2NH $$ | ۷٫۴ |
| آمین نوع سوم | $$ (CH_3)_3N $$ | ۳٫۵ |
در ادامه به بررسی الگوهای تغییر نقطه جوش و دلایل این تغییرات میپردازیم.
آمین نوع اول
برای درک بهتر ابتدا نقطه جوش متیل آمین یعنی سادهترین آمین نوع اول را با اتان مقایسه میکنیم. فرمول شیمیایی متیل آمین بهصورت $$CH_3NH_2$$ و فرمول شیمیایی اتان بهصورت $$CH_3CH_3$$ است. هر دو این مولکولها تعداد الکترون برابری دارند و از نظر شکل مولکول نیز بسیار مشابه یکدیگر هستند. با این حال در مقدار نقطه جوش آنها تفاوت بسیار زیادی وجود دارد. نقطه جوش متیل آمین برابر با ۶٫۳- درجه سانتیگراد و نقطه جوش اتان بسیار پایینتر و برابر با ۸۸٫۶- درجه سانتیگراد است.
دلیل بالا بودن نقطه جوش آمینهای نوع اول نسبت به آلکان همتای خود این است که توانایی تشکیل پیوند هیدروژنی را علاوه بر نیروی واندروالسی و برهمکنش دوقطبی-دوقطبی دارند. پیوند هیدروژنی بین اتم نیتروژن الکترونگاتیو با زوجالکترون تنها و اتم هیدروژن اندکی مثبت در مولکول دیگر تشکیل میشود که میتوانید نحوه تشکیل آن را در تصویر زیر مشاهده کنید.
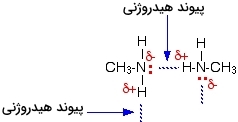
در اینجا تشکیل پیوند هیدروژنی به کارآمدی مولکولهایی مانند آب نیست زیرا با کمبود زوجالکترون تنها روبرو هستیم، بهصورتی که تعدادی از هیدروژنهای مثبت نمیتوانند برای تشکیل پیوند هیدروژنی زوجالکترونی بیابند. تعداد هیدروژنهای مثبت دو برابر تعدادی زوجالکترونهای تنها روی نیتروژنها است. نقطه جوش آمینهای نوع اول با افزایش طول زنجیره افزایش پیدا میکنید زیرا مقدار نیروی واندروالسی بین مولکولهای بزرگتر بیشتر است.
آمین نوع دوم
در آمینهای نوع دوم مقایسه را بین دیمتیل آمین و اتیل آمین انجام میدهیم که ایزومر یکدیگر هستند و در آنها تعداد برابری از انواع اتمها وجود دارد. نقطه جوش آمین نوع دوم به مقدار اندکی از آمین نوع اول با همان تعداد کربن پایینتر است. آمینهای نوع دوم نیز قادر به تشکیل پیوند هیدروژنی هستند اما وجود اتم نیتروژن در وسط مولکول به جای انتهای آن، باعث کمتر شدن مقدار گشتاور دوقطبی در آن میشود. بنابراین میتوان اینطور جمعبندی کرد که نقطه جوش پایین دیمتیل آمین نسبت به اتیل آمین به دلیل کمتر تفاوت در مقدار گشتاور دوقطبی این دو مولکول است.

آمین نوع سوم
در این مورد میخواهیم دو ایزومر تریمتیل آمین و ۱-آمینو پروپان را با یکدیگر مورد مقایسه قرار دهیم. با نگاهی به جدول بالا متوجه میشویم که مقدار نقطه جوش تریمتیل آمین برابر با ۳٫۵ درجه سانتیگراد و نقطه جوش ۱-آمینو پروپان برابر با ۴۸٫۶ درجه سانتیگراد است. به این صورت نقطه جوش ۱-آمینو پروپان مقدار بسیار بزرگتری است. همانطور که میدانید در آمینهای نوع سوم هیچ اتم هیدروژنی بهصورت مستقیم به نیتروژن آمینی متصل نیست و در این حالت امکان تشکیل پیوند هیدروژنی در آمین نوع سوم وجود ندارد که همین دلیل کمتر بودن نقطه جوش آن است.
انحلالپذیری آمینها در آب
انواع آمینهای کوچک در آب حل میشوند، در واقع بسیاری از آمینهایی که در دمای اتاق بهصورت گاز حضور دارند، برای فروش در حالت محلول در آب قرار دارند. تمام آمینها توانایی تشکیل پیوند هیدروژنی با آب را دارند، حتی آمین نوع سوم که در بخش قبل به عدم توانایی آن در تشکیل پیوند هیدروژنی با خود اشاره کردیم. در این پیوند هیدروژنی اتم نیتروژن زوجالکترون تنهای خود را در اختیار آب قرار میدهد و میتوانید نحوه تشکیل پیوند هیدروژنی آن با آب را در تصویر زیر مشاهده کنید.
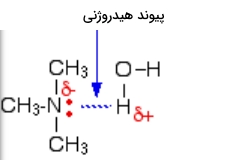
با افزایش طول زنجیرههای جانبی در انواع آمین ها از انحلالپذیری آنها کاسته میشود و این مورد در آمینهایی با بیش از ۶ اتم کربن قابل مشاهده است. این زنجیرههای جانبی برای انحلالپذیری باید مسیر خود را بین مولکولهای آب باز کنند و در این فرآیند باعث شکستن پیوندهای هیدروژنی در آب میشوند. در این فرآيند پیوند هیدروژنی با پیوند قویتری جایگزین نمیشود بنابراین فرآيند انحلال از نظر انرژی مناسب نیست و با رشد زنجیره هیدروکربنی از مقدار آن کاسته میشود.
بوی انواع آمین ها
آمینهای کوچکی مانند متیل آمین و اتیل آمین بویی بسیار شبیه به بوی آمونیاک دارند اما با بررسی دقیقتر مقایسه متوجه میشویم که بوی آمینها پیچیدگی بیشتری دارد. هرچه آمینی بزرگتر باشد بویی شبیهتر به بوی ماهی و فساد از خود بروز میدهد.
مثال و حل تمرین
تا اینجا به معرفی نواع آمینها پرداختیم و با روش نامگذاری و واکنشهای آنها آشنا شدیم. در این بخش میخواهیم تعدادی مثال و تمرین چندگزینهای را بررسی کنیم.
مثال
در این بخش چند مثال را بررسی میکنیم و در هر مورد پاسخ تشریحی آنها را نیز آوردهایم. توجه به این پاسخ تشریحی میتواند در پاسخگویی به پرسشهای مشابه کمککننده باشد.
مثال اول
دو ساختار زیر مربوطه به ایزوپروپیل آمین و ایزوپروپیل الکل هستند. بگویید چرا با وجود داشتن ساختار مشابه، آمین از نوع اول و الکل از نوع دوم است؟
پاسخ
در دستهبندی الکلها، تعداد اتمهای کربن متصل به کربن هیدروکسیلی اهمیت دارد. در این ساختار به کربنی که روی آن هیدروکسیل است، ۲ کربن دیگر وصل شده است، بنابراین الکل از نوع دوم خواهد بود اما برای تعیین انواع آمین ها تعداد اتمهای کربنی که بهصورت مستقیم به نیتروژن متصل هستند، مهم است که در اینجا ۱ کربن است و بنابراین آمین از نوع اول نامیده میشود.

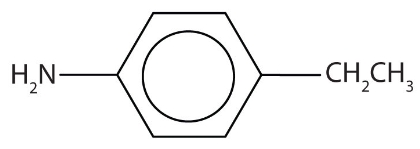
مثال دوم
نام آمین آروماتیک زیر چیست؟
پاسخ
این مولکول مربوط به یک آنیلین است که در موقعیت ۴ خود یک گروه اتیل دارد. استخلافهایی که نسبت به آمین در موقعیت ۴ قرار داشته باشند را میتوان با پیشوند «پارا» مشخص کرد. بنابراین نام این مولکول «پارا اتیل آنیلین» یا «۴-اتیل آنیلین» است.
مثال سوم
نام ترکیب زیر را با توجه به قوانین نامگذاری آمینها بنویسید.
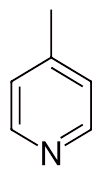
پاسخ
همانطور که پیشتر گفتیم حلقه آروماتیکی که یکی از کربنهای آن با نیتروژن جایگزین شده باشد، پیریدین نام دارد. حال روی این حلقه پیریدینی یک استخلاف بهصورت متیل وجود دارد که باید نام آن را به همراه موقعیت پیش از نام پیریدین بیاوریم.
برای شمارهگذاری اتمهای داخل حلقه، ابتدا به نیتروژن عدد ۱ را نسبت میدهیم. سپس چه شمارهگذاری را پادساعتگرد انجام دهیم، چه ساعتگرد نتیجه یکسان است و به کربن متیل عدد ۴ تعلق میگیرد. بنابراین نام این مولکول «۴-متیل پیریدین» است.
مثال چهارم
نام ترکیب آمینی زیر چیست؟
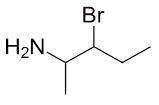
پاسخ
مولکول زیر را میتوان مانند زنجیره هیدروکربنی در نظر گرفت که روی آن یک گروه آمین و یک برم وجود دارد. این زنجیره از ۵ اتم کربن تشکیل شده است. برای شمارهگذاری این زنجیره آن را از چپ به راست مولکول شمارهگذاری میکنیم تا به کربن آمین عدد ۲ و به استخلاف برمو عدد ۳ نسبت داده شود.
در صورتی که این شمارهگذاری از راست به چپ بود، به آمین عدد ۴ و به برم عدد ۳ نسبت داده میشد که نادرست بود. بنابراین نام این مولکول بهصورت «۳-برمو پنتان ۲-آمین» صحیح است.
مثال پنجم
نام آمین حلقوی زیر چیست؟
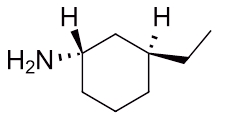
پاسخ
همانطور که مشاهده میکنید این مولکول حلقهای ۶ کربنی با دو استخلاف است. یکی از این استخلافها آمین است و دیگری زنجیرهای با دو اتم کربن به نام اتیل. برای نامگذای باید موقعیت هر کدام از آنها را روی حلقه به دست بیاوریم. برای این کار ابتدا به نیتروژن عدد ۱ را نسبت میدهیم و سپس شمارهگذاری را بهصورت ساعتگرد ادامه میدهیم تا به اتیل عدد ۳ نسبت داده شود.
با توجه به صلب بودن حلقه جهتگیری استخلافها نسبت به یکدیگر نیز اهمیت دارد و باید در نام مولکول آورده شود. در این مولکول آمین با نقطهچین مشخص شده و پشت صفحه قرار دارد اما اتیل با گوه مشخص شده و در جلوی صفحه است، بنابراین این دو نسبت به یکدیگر ترانس هستند و نام این مولکول بهصورت «ترانس ۳-اتیل سیکلوهگزان آمین» صحیح است.
مثال ششم
نحوه نامگذاری آمین زیر را توضیح دهید.
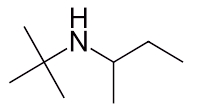
پاسخ
در این گروه آمینی ۲ تم هیدروژن توسط گروههای آلکیلی جایگزین شدهاند و هر دو دارای زنجیرهای با ۴ اتم کربن هستند. با کمی دقت متوجه میشویم که این دو زنجیره با یکدیگر متفاوت هستند. زنجیره سمت راست از کربن نوع دوم به نیتروژن متصل است، یعنی کربنی که خود با ۲ اتم کربن دیگر پیوند برقرار میکند.
زنجیره سمت چپ از کربن نوع سوم به نیتروژن وصل شده است. کربن نوع سوم خود به ۳ عدد کربن دیگر اتصال دارد، بنابراین نامگذاری آنها نیز متفاوت خواهد بود. نام این مولکول بهصورت «سک-بوتیل ترت-بوتیل آمین» صحیح است.
تمرین
حال که تعدادی مثال را به همراه پاسخ تشریحی بررسی کردیم، در این بخش به سراغ تعدادی تمرین چندگزینهای میرویم.
تمرین اول
دیمتیل ایزوپروپیل آمین
متیل و متیل ایزوپروپیل آمین
ایزوپروپیل دیمتیل آمین
دیمتیل پروپیل آمین
تمرین دوم
۳-آمینو ۲-متیل پنتان
۲-آمینو ۳-متیل پنتان
۲-آمینو ۳-اتیل بوتان
۲-آمینو ۳و۴-متیل بوتان
تمرین سوم
نام دو ترکیب زیر را با توجه به قوانین گفته شده به ترتیب چیست؟
$$(CH_3)_2NH_2^+$$ و $$(CH_3)_4N^+$$
دیمتیل آمونیوم یون و تترامتیل آمونیوم یون
تترا متیل آمونیوم یون و تریمتیل آمونیوم یون
تریمتیل آمونیوم یون و متیل آمونیوم یون
دیمتیل آمونیوم یون و بوتیل آمونیوم یون
تمرین چهارم
اتصال مستقیم گروه $$NH_2$$ به کدام یک از گزینههای زیر باعث به وجود آمدن ساختار آنیلین میشود؟
تمرین پنجم
دیسیکلو پنتیل آمین
سیکلو پنتیل آمین
۱و۲-دیسیکلو آمینو پنتان
دیسیکلو پنتان آمین
تمرین ششم
۱و۴-پنتان دیآمین
۱و۴- آمینو پنتیل
دی-پنتان دیآمین
۱و۴-دی پنتان آمین
تمرین هفتم
اتیل آمونیوم برمید
تریاتیل آمونیوم برمید
برمو تریاتیل آمونیوم
آمونیوم برمو تریاتیل
تمرین هشتم
۶-برمو ۴-آمینو ۲-هپتانول
۴-برمو ۶-آمینو ۲-هپتانول
۶-آمینو ۴-برمو هپتان ۲-اُل
۲-هپتانول ۶-برمو ۴-آمینو
تمرین نهم
۱و۴-دیمتیل پیران
۱و۴-دیمتیل پیرول
۱و۴-دیمتیل پیریدین
۱و۴-دیمتیل پیپیریدین
سوالات متداول
حال که در این مطلب با انواع آمین ها و روش سنتز آنها آشنا شدیم، میخواهیم در این بخش به تعدادی از مهمترین پرتکرارترین سوالهای موجود پیرامون آن پاسخ دهیم.
نوکلئوفیل چیست؟
نوکلئوفیل گونهای است که به بخشهایی از مولکول یا یون دیگر که دارای بار مثبت هستند، تمایل دارد و به آنها حمله میکند.
آمین نوع دوم چیست؟
در این نوع آمین، ۲ اتم کربن بهصورت مستقیم به نیتروژن متصل است.
واکنش حذف هافمن چیست؟
به واکنش حذف نمکهای آمونیوم نوع چهارم، حذف هافمن گفته میشود
آمین نوع سوم چیست؟
به نیتروژن این آمین ۳ اتم کربن بهصورت مستقیم وصل است.
جمعبندی
هدف از این مطلب مجله فرادرس بررسی ساختار انواع آمین ها در شیمی آلی بود. در ابتدا به بررسی انواع آمین ها با توجه به دستهبندی آنها پرداختیم. سپس واکنشهایی که آمین در آنها شرکت میکنند را مورد بررسی قرار دادیم. در بررسی این واکنشها تلاش کردیم تا با مثالهایی واقعی درک بهتری از نحوه انجام آنها به دست آوریم.
در ادامه ویژگیهای فیزیکی و شیمیایی انواع آمین ها مانند انحلالپذیری و نقطه جوش را مورد بررسی قرار دادیم و مقادیر آنها را در آمینهای مختلف مرور کردیم. در نهایت نیز برای محک دانش خود از این مفهوم تعدادی مثال را به همراه پاسخ تشریحی مرور کردیم و به چند تمرین چندگزینهای پرداختیم.
source